2023-08-03至2023-09-30上海
首次解析!Cell: 斯坦福科学家利用类器官精准定位新冠病毒进出鼻腔细胞的途径
来源:beplay2.com
大家都知道这场持续了三年之久的疫情是由新型冠状病毒引起的,可能还有些人了解新冠病毒是一个单链RNA病毒,它是使用自己的刺突蛋白,与细胞上的血管紧张素转化酶酶2(简称ACE2)受体结合来完成识别的,接着病毒就会进入宿主细胞并开始复制,最终引发疾病。但病毒究竟是如何进入呼吸系统的,病毒进入呼吸道上皮细胞以及如何在细胞间传播的分子机制尚不清楚。
2023年1月5日,来自斯坦福大学的科研团队在著名期刊
Cell
杂志在线发表了一篇名为
《SARS-CoV-2 replication in airway epithelia requires motile cilia and microvillar reprogramming》
的研究文章,这项研究
首次详细阐述了新冠病毒感染呼吸道上皮细胞的分子机制
,研究人员发现
病毒通过ACE2受体附着在上皮细胞的纤毛上,并且使用纤毛作为进入细胞的通道。
鼻子是上呼吸道粘膜免疫的重要组成部分,它参与宿主保护的免疫稳态。鼻粘膜防御主要有两种类型,从生理角度上来说,由紧密结合的纤毛细胞、杯状细胞和基底上皮细胞、双层黏液层和基底膜构成的屏障是最主要的防御手段,但我们还不清楚哪些类型的细胞最先被感染。
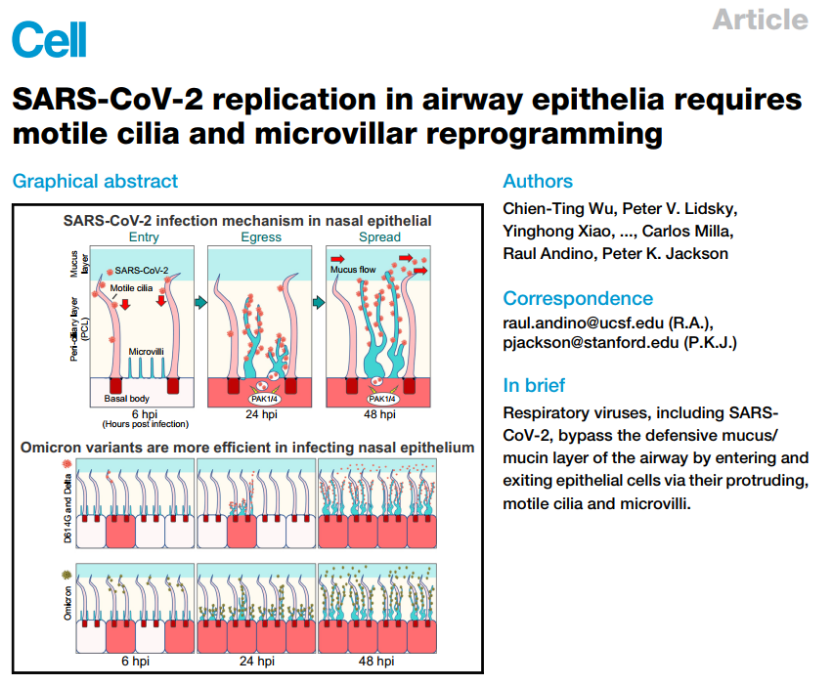
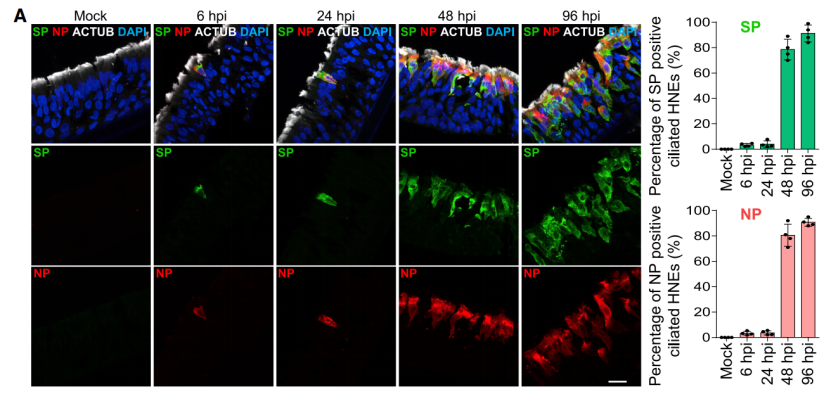
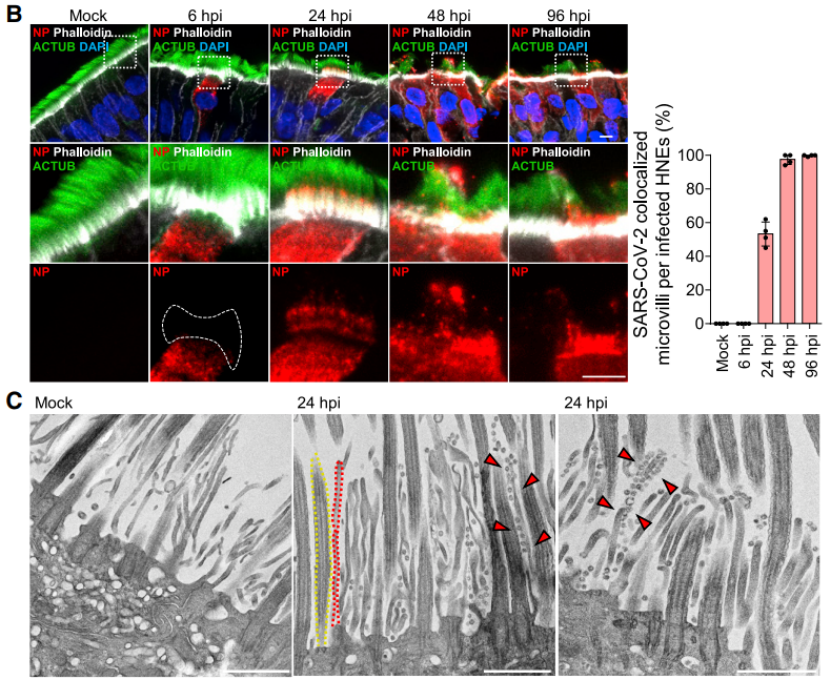
作者首先利用原代细胞培养分化的手段生成了纤毛细胞、杯状细胞和基底细胞的鼻上皮类器官,这种类器官包括了正常人上气道上皮的形态和功能,接着用新冠病毒去感染培养的类器官,结果发现新冠病毒核衣壳蛋白和刺突蛋白只有在感染后的6、24 和 48 小时的时候在纤毛细胞中可见,这表明纤毛细胞更加容易被早期感染,因此,纤毛细胞是SARS-CoV-2在鼻上皮中的主要进入部位。
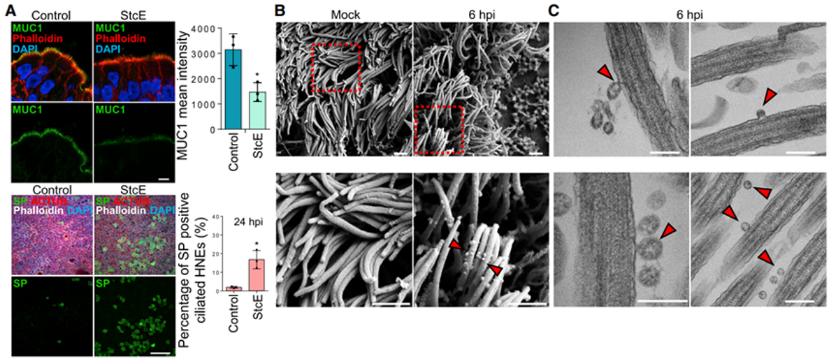
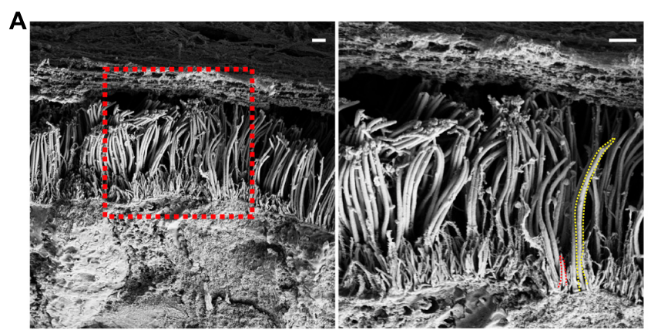
进一步的,为了更好地了解鼻上皮中的病毒感染,作者探究了病毒从少数最初感染的细胞中排出的情况,结果发现病毒感染促进了细胞丝状伪足突起,诱导含病毒的丝状伪足可能对SARS-CoV-2的释放和后代病毒粒子在细胞间传播很重要。因此,作者使用透射电镜和IF染色系统地展示了原代气道上皮细胞中的微绒毛样结构。在纤毛状类器官的顶端表面上观察到两类突起:长而宽的活动纤毛和粗短的圆顶状微绒毛(图3A),接下来,通过共聚焦和免疫组化实验作者证明了SARS-CoV-2与微绒毛相互作用,使其能在受感染动物的呼吸道内传播。
鉴于在细胞中调节激酶能够控制细胞骨架的生成,作者探究了是哪些激酶被调控后促进了微绒毛的高度延伸,通过磷酸化蛋白质组学的手段,作者最终确定了五种激酶,包括细胞骨架重组p21活化激酶1和4(PAK1和PAK4),丝氨酸/苏氨酸激酶(AKT1/2),丝裂原活化蛋白激酶(p38)、丝裂原活化蛋白激酶(ERK1)和含有蛋白激酶1的ROCK1。作者确定这些激酶是否在感染细胞中磷酸化,所有五种药物均在类器官中被激活。
在动物实验中,研究人员采用鼻喷雾剂将SLK和PAK4激酶抑制剂应用于K18-hACE2转基因小鼠,结果PAK4激酶抑制剂可以部分抑制感染的水平,这为开发鼻腔喷雾剂来预防病毒感染提供了借鉴的范例。
总的来说,作者
发现新冠病毒会首先感染呼吸道纤毛细胞,如果移除纤毛,则可阻止新冠病毒和其他呼吸道病毒的感染
,同时,侵入的病毒会激活细胞中激酶来促进细胞骨架的形成,通过高度延伸的微绒毛结构将新生成的病毒送到黏液层,从而提高了病毒的传播能力。
2. Hellings PW, Steelant B. Epithelial barriers in allergy and asthma. J Allergy Clin Immunol. 2020 Jun;145(6):1499-1509.
3. Gallo O, Locatello LG, Mazzoni A, Novelli L, Annunziato F. The central role of the nasal microenvironment in the transmission, modulation, and clinical progression of SARS-CoV-2 infection. Mucosal Immunol. 2021 Mar;14(2):305-316.